在传统生物学认知中,细胞内部的空间组织往往被理解为一种“膜驱动的分区逻辑”:线粒体、内质网、高尔基体等细胞器,似乎都依赖脂质膜将不同反应过程彼此隔离。然而,近十余年来,细胞生物学领域的一系列研究正在不断修正这一图景。研究发现,细胞内大量关键功能区室——例如核仁、应激颗粒(stress granules)以及 P-bodies——并不具备任何膜结构。它们既不是被“包”出来的,也不是通过囊泡运输形成的,而是源于一种更为基础、也更具物理意味的过程:液–液相分离(Liquid–Liquid Phase Separation, LLPS)。在这一机制下,蛋白质、RNA 等生物大分子在拥挤的水相环境中,因相互作用差异而发生自发分相,形成成分高度富集的液态凝聚体。这些结构看似“柔软”“松散”,却具备清晰的空间边界:它们能够选择性富集特定分子、排斥无关组分,并在需要时快速组装或解体。与刚性的膜结构不同,这类界面是柔性的、动态的、可逆的,但在功能上却高度有序,足以支撑复杂的生化反应网络。
从更宏观的视角来看,这种无膜分区方式甚至被认为可能与生命起源的早期形态密切相关。有学者提出,在尚未进化出稳定脂质膜之前,原始生命体系很可能正是以类似“水包水”结构的液态凝聚体形式存在:在纯水环境中,通过分子间相互作用自发形成分区,实现化学反应的空间隔离与协同。这类结构无需复杂合成路径,却天然具备“聚集—分散—再组织”的能力,被视为原始生命体系的重要候选模型。正是这些被称为“软分区”或“无膜分区”的发现,使人们开始重新思考“分区”这一概念本身——它未必需要坚硬的边界,也不一定依赖油–水界面。对于材料科学,尤其是微胶囊与微结构工程而言,这一认识提供了一条极具启发性的全新路径:是否可以在完全水相的条件下,仅依靠相分离,就构建出稳定、可控、功能分区明确的微结构?这一问题的答案,正逐步指向全水相相分离与“水包水”微胶囊体系的兴起(图 1)。

图 1 可能的早期生命存在形式:“水包水”结构凝聚体
(DOI: 10.1002/pep2.24331)
一、从类细胞分区到全水相相分离
在细胞尺度上,LLPS 的本质可以概括为一句话:在高度拥挤的水相环境中,不同生物大分子之间的相互作用差异,足以驱动体系自发分成两个互不相容、但仍然都是“水”的相。这种分区不是靠“墙”隔开的,而是由热力学不相容性自然生成的:两相都富含水;界面连续、柔性、可变形;组分在不同相中具有显著的分配差异。当这一思想被移植到人工体系中,便形成了所谓的全水相相分离(Aqueous–Aqueous Phase Separation, AAPS)。在工程实践中,只需在水中引入两种(或多种)彼此不相容的亲水高分子——例如,PEG / 多糖, PEG / 明胶,蛋白 / 多糖体系,并将其浓度调控在合适区间内,体系就会自发分成两个水相。宏观上看,它仍是一杯“透明的水溶液”;微观上,却已经形成了清晰的相界面与组分分区。正是这种“无油、无膜、仍可分区”的特性,使AAPS 成为构建类细胞微结构的理想物理基础。
二、从AAPS到“水包水”(W/W)复乳液滴
当全水相相分离进一步与微尺度操控结合,一类非常独特的体系应运而生——“水包水”(Water-in-Water, W/W)复乳液滴。与传统乳液的逻辑完全不同,这类体系的核心思路并不是:先制造液滴 → 再用强界面稳定它。而是:先通过相分离“写出结构”,再通过固化把结构“锁住”。一个典型的构建流程如下:
两种亲水高分子在水中发生全水相相分离
其中一相以液滴形式分散在另一水相中,形成 W/W 液滴
在结构尚未粗化或塌陷前,通过交联或凝胶化将其固定
最终获得稳定的“水包水”微胶囊结构
与传统油–水微胶囊相比,这类体系具有若干本质差异:界面张力极低,更接近细胞内环境;无需乳化剂与有机溶剂;内外相同为水,但“成分不同”,更利于生物活性保持;天然具备活性分子选择性分配能力。因此,基于“水包水”复乳构建微胶囊并非传统乳化方式的简单替代,而是提供的一条全新技术路线:将目标从“包裹材料”转向“模拟生命分区”。
三、基于 W/W体系构建微胶囊的关键工程要素
在工程实践中,基于 W/W 复乳液滴构建微胶囊,通常需要从以下四个方面进行系统设计。
(1) 体系选择与相图设计:结构的“蓝图”
这是所有工作的起点。通过调控:聚合物种类(图2);分子量;浓度;温度与离子强度。将体系工作点精准放入 AAPS 相区,使相分离既能发生,又不过度粗化。
(2) W/W 复乳液滴的生成方式
尽管液滴的“驱动力”来自相分离,但液滴尺度仍需外部调控。常见手段包括:全水相微流控造滴;共挤出或低剪切滴制(图3);重力或振动辅助液滴化等。由于W/W界面极软,这些方法通常可以在远低于传统乳化所需剪切条件下运行,尤其适合生物体系。
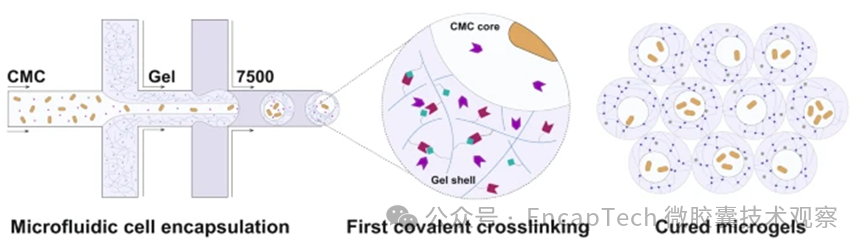
(3) 活性组分的分配设计:真正像细胞一样“分工”
活性组分可以通过预先加入某一水相中或利用其在两水相中的分配系数差异,自发富集,从而实现内核富集酶或蛋白,外相承担保护或缓释功能,界面区域作为反应或调控层。
(4) 固化与稳定策略:如何把结构“封存”下来?
相分离决定结构能否出现,而固化决定结构能否长期存在。常见策略包括:离子交联,如多糖体系中的 Ca²⁺ 诱导凝胶化;酶促交联,该方式温和、选择性高,适合生物体系;光交联,如 GelMA、PEGDA,实现时空可控固定(图3);温度响应凝胶化,如明胶等体系。关键原则只有一个:固化发生的时间窗口,必须晚于相分离形成、早于结构塌陷。在这一意义上,固化并不是“塑形”,而是对一个已形成的热力学结构进行“封存”。
四、部分典型应用方向
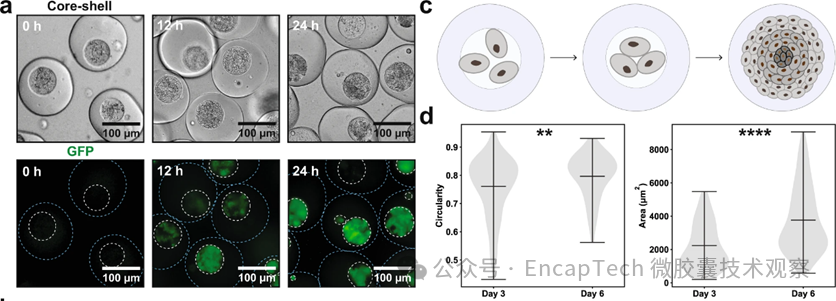
细胞与微生物温和包覆(图4)
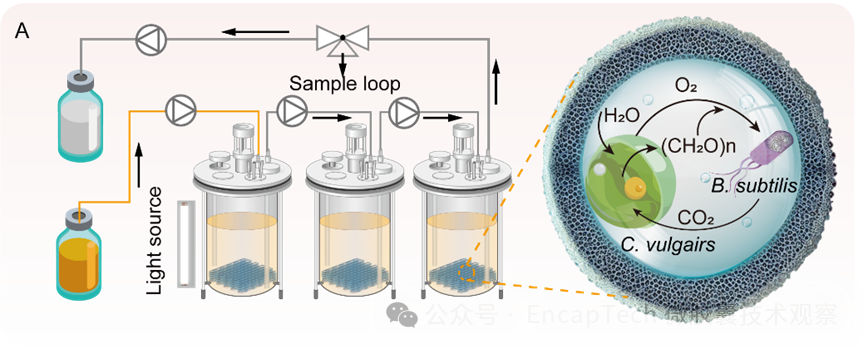
工程化活体材料与多细胞系统构建(图5)
四、总结 — 一种更接近生命逻辑的微胶囊制备路线
从细胞内无膜分区的发现,到全水相相分离的工程化应用,再到基于 W/W 复乳液滴构建微胶囊,这条技术路线的真正价值,并不在于“新”,而在于逻辑的转变:
从强界面 → 软界面
从外力主导 → 自组织主导
从“包裹” → “分区”
当微胶囊被赋予的不再只是“装东西”,而是组织功能、调控反应、模拟生命空间结构的能力时,全水相相分离提供了一种极具前瞻性的材料学答案。随着该策略在活体材料、多细胞系统与功能性微结构中的不断拓展,可以预期,基于“水包水”模板的微胶囊构建将不只是一个制备技巧,而是一种重新理解和设计复杂微结构的有效方式和途径。
|
|
https://www.chem234.com/news/show.php?itemid=4068
|









